Oxydoréduction : Cours et Exercices corrigés
Oxydoréduction : Cours et Exercices corrigés
Les réactions d’oxydoréduction sont des réactions dans lesquelles des électrons sont transférés entre réactifs. Par exemple, la rouille du fer, le blanchiment des cheveux, la production d’électricité dans les batteries résultent de réactions d’oxydoréduction.
Beaucoup de ces réactions mettent en jeu le dioxygène :

La plupart des réactions d’oxydoréduction ne nécessitent pas la présence de dioxygène. Par exemple, dans la réaction suivante :
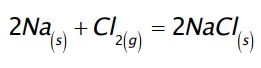
un métal (qui a tendance à perdre un électron) réagit avec un non métal (qui a tendance à gagner un électron) . L’élément métallique (le sodium) cède un électron au non métal (le dichlore).
Par définition, une oxydation est une perte d’électrons et une réduction est un gain d’électrons.
I- Couple oxydant-réducteur
- On appelle oxydant une entité (atome, molécule ou ion) capable de capter au moins un électron (noté e‒) au cours d’une réaction chimique :
- Oxydant = capteur d’électrons
- On appelle réducteur une entité (atome, molécule ou ion) capable de céder au moins un électron au cours d’une réaction chimique :
- Réducteur = donneur d’électrons
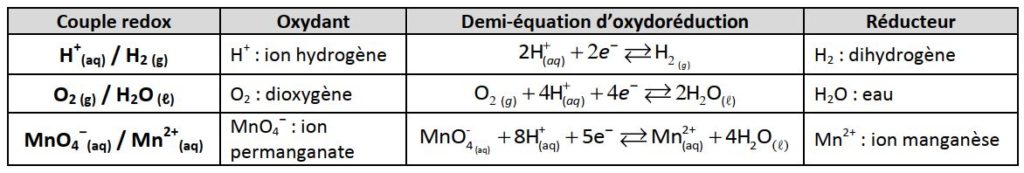
- Un oxydant et un réducteur sont dits conjuguées et forment un couple redox (noté Oxydant/Réducteur) si on peut les relier par une demi-équation d’oxydoréduction :

Exemples :
II- L’état d’oxydation, le nombre d’oxydation
Dans une réaction d’oxydoréduction entre un métal et un non métal, il est facile de « suivre » le transfert d’électrons entre le réducteur et l’oxydant. Cela est plus difficile lorsque la réaction met en jeu deux non métaux. Pour « suivre » le transfert d’électrons, les chimistes ont construit un outil commode qui fait appel au nombre (ou degré) d’oxydation . Ce dernier permet de savoir si un élément chimique peut être réduit (il a gagné un ou des électrons) ou oxydé (il a perdu ou gagné un électron) qu’il soit seul ou engagé dans un édifice moléculaire ou ionique.
Nous allons donc attribuer à chaque élément chimique un nombre d’oxydation en suivant les règles suivantes :
Règle 1: Le nombre d’oxydation d’un élément dans un corps pur simple atomique ou moléculaire est égal à 0.
Règle 2: Le nombre d’oxydation d’un élément dans un ion monoatomique est égal à la charge de cet ion.
Règle 3: La somme de tous les n.o des éléments dans :
- une molécule neutre est égal à 0.
- un ion est égal à la charge de cet ion.
Règle 4: Dans des composés, les éléments métalliques ont des n.o positifs :
- Les éléments du groupe 1A (alcalins) ont toujours un n.o de +I.
- Les éléments du groupe 2A (alcalino-terreux) ont toujours un n.o de +II.
Règle 5 : Dans des composés, les éléments non métalliques suivants ont les n.o indiqués dans le tableau suivant:
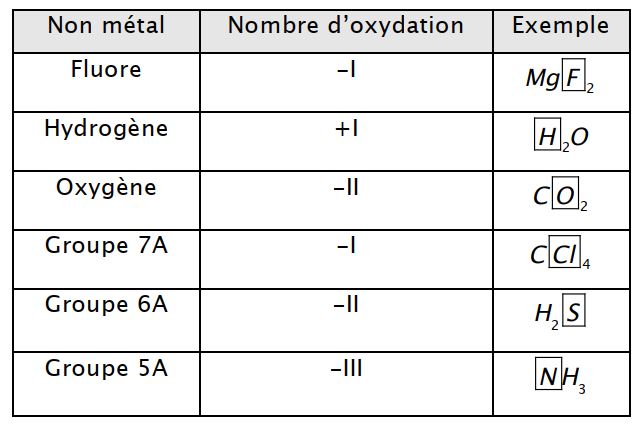
Ces résultats peuvent s’expliquer en étudiant la structure de Lewis des molécules et à partir de l’électronégativité des éléments. Il faut noter des exceptions : pour l’élément oxygène, dans le peroxyde d’hydrogène H2O2 (eau oxygéné),n.o(O) = -I , pour l’élément hydrogène, dans les hydrures métalliques tels que LiH et NaH , n.o(H) = -I .
Quand on cherche à déterminer le n.o d’un élément, il faut retenir les points suivants :
- Le n.o d’un élément dépend des autres éléments présents dans le composé à l’exception des alcalins et alcalino-terreux dont les n.o sont toujours les mêmes.
- La règle 3 est toujours vérifiée.
- Quand on veut déterminer le n.o d’un élément qui n’est pas couvert par les règles 4 et 5 (comme le carbone), il faut utiliser la règle 3.
III- Pile électrochimique
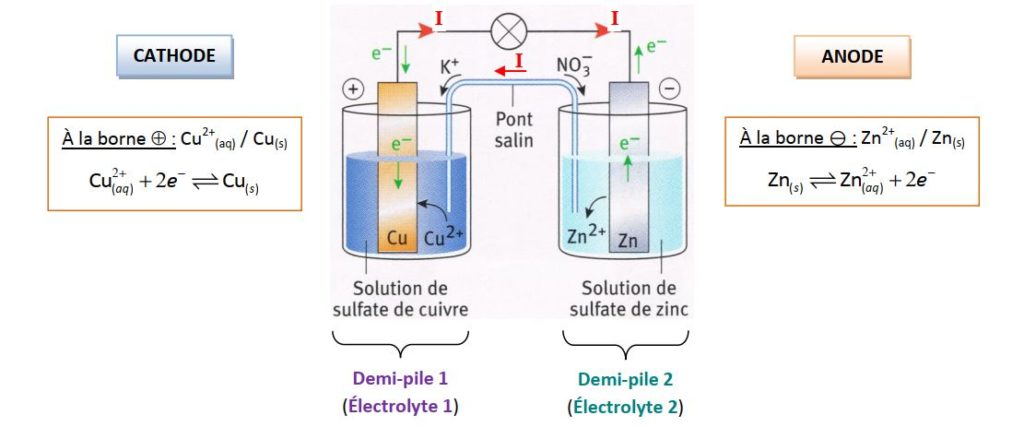
Une pile est un générateur électrochimique (conversion d’énergie chimique en énergie électrique) dans lequel se déroule une réaction d’oxydoréduction entre deux couples redox. Il est constitué de deux parties (appelées demi-piles), reliées par un pont salin, comportant chacune un conducteur métallique (appelés électrode) en contact avec un milieu ionique (conducteur) appelé électrolyte.
- L’électrode où se produit une réduction est appelée la cathode ;
- L’électrode où se produit une oxydation est appelée l’anode.
Fonctionnement d’une pile :
- À l’intérieur de la pile, le passage du courant électrique est assuré par des ions (porteurs de charges) : les cations se déplacent dans le sens du courant (vers la borne + ) et les anions se déplacent en sens inverse (vers la borne – ) ;
- À l’extérieur de la pile, le passage du courant électrique est assuré par des électrons (porteurs de charge) : ils se déplacent de la borne – vers la borne + (sens inverse du sens conventionnel du courant) ;
- Le pont salin assure la continuité électrique et la neutralité électrique entres les deux demi-piles.
Réactions aux électrodes :
Les réactions aux électrodes se déduisent du sens de déplacement des électrons :
- Au pôle négatif de la pile, des électrons sont libérés selon la demi-réaction suivante (oxydation) :
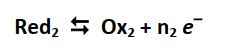
(Le métal est consommé et des ions métalliques sont formés)
- Au pôle positif de la pile, les électrons qui arrivent sont captés selon la demi-réaction suivante (réduction) :
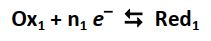
(Des ions métalliques sont consommés et des atomes métalliques sont formés)
Réaction de fonctionnement :
Lorsque la pile fonctionne, une réaction chimique à lieu dont l’équation correspond au bilan des réactions électrochimiques qui se déroulent à chacune des électrodes de la pile :
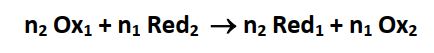
La pile transforme donc de l’énergie chimique en énergie électrique qu’elle transfère au circuit extérieur : c’est un générateur électrochimique. Une partie de l’énergie libérée est dissipée par effet Joule.
Lorsqu’on recharge un accumulateur, les espèces chimiques qui ont été consommées aux électrodes sont régénérées : le sens de la réaction d’oxydoréduction est inversé grâce à un apport d’énergie.
Pour plus de détails télécharger les documents ci-dessous:
Liens de téléchargement des cours sur les réactions d’Oxydoréduction
Cours sur les réactions d’Oxydoréduction N°1
Cours sur les réactions Oxydoréduction N°2
Cours sur les réactions d’Oxydoréduction N°3
Cours sur les réactions d’Oxydoréduction N°4
Cours sur les réactions d’Oxydoréduction N°5
Cours sur les réactions d’Oxydoréduction N°6
Cours sur les réactions d’Oxydoréduction N°7
Liens de téléchargement des exercices corrigés sur les réactions d’Oxydoréduction
Exercices corrigés sur les réactions d’Oxydoréduction N°1
Exercices corrigés sur les réactions d’Oxydoréduction N°2
Exercices corrigés sur les réactions d’Oxydoréduction N°3
Exercices corrigés sur les réactions d’Oxydoréduction N°4
Exercices corrigés sur les réactions d’Oxydoréduction N°5
Exercices corrigés sur les réactions d’Oxydoréduction N°6
Exercices corrigés sur les réactions d’Oxydoréduction N°7
