Réaction acido-basique : Cours, résumés et exercices corrigés
Réaction acido-basique : Cours, résumés et exercices corrigés
Une réaction acide-base est une réaction d’échange d’ion H+ entre un donneur de H+ (acide) et un accepteur d’ion H+ (base).
I- Acide et base : définitions selon la théorie de Brönsted et Lowry
- Un acide est un donneur de proton (ou une espèce capable d’en faire céder un par le solvant).
Un acide, au sens de Brönsted, est une espèce chimique capable de céder (perdre) un ion hydrogène H+.
- Une base est un accepteur de proton
Une base, au sens de Brönsted, est une espèce chimique capable de capter (gagner) un ion hydrogène H+
Remarque :
Selon les cas, les acides et les bases peuvent être des espèces ioniques ou non. Lorsqu’elles sont ioniques, elles n’existent pas seules en solution, elles sont toujours accompagnées d’un ion spectateur qui permet d’assurer l’électroneutralité.
Par exemple, l’acide chlorhydrique HCL se dissout dans l’eau en ions oxonium H3O+ et chlorure Cl–. Seuls les ions H3O+ sont porteurs du caractère acide, les ions Cl– sont spectateurs.
II- Structure d’un acide et d’une base
II-1. Structure d’un acide
Lorsqu’une molécule présente une liaison polarisée entre un hydrogène et un atome plus électronégatif, on dit que la molécule est acide. La liaison est fragilisée par cette polarité et la molécule peut ainsi céder plus ou moins facilement l’ion H+.
II-2. Structure d’une base
Lorsqu’une molécule présente un atome portant un ou plusieurs doublets non-liant, comme l’atome d’azote par exemple, alors cette molécule est une base. Ces doublets non-liant sont des réserves d’électrons susceptibles de venir combler la lacune électronique d’un ion H+ pour le capter.
II-3. Exemple
La photo ci-dessous présente le schéma de Lewis de l’acide éthanoïque et de l’ammoniac, respectivement un acide et une base.
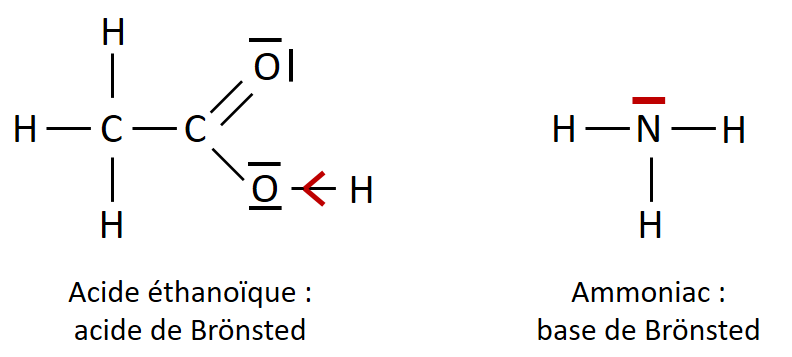
III- Réactions acido-basiques
III-1. Couple acide-base
Lorsqu’un acide noté AH cède un proton H+, il se transforme en sa base conjuguée notée A– selon la demi-équation suivante :
AH = A– + H+
On dit que le couple AH/A– est un couple acide-base.
Remarque :
Certaines espèces peuvent à la fois jouer le rôle de base et d’acide. Elles sont appelées espèces amphotères, ou ampholytes.
L’eau H2O est une espèce amphotère, elle est la base conjuguée de l’ion oxonium H3O+ et l’acide conjugué de l’ion hydroxyde HO–. Les deux couples acide-base associés sont H3O+/H2O et H2O/HO–.
III-2. Réaction acido-basique
Soient deux couples acide-base A1H/A1– et A2H/A2–. Une réaction acido-basique (aussi appelée réaction par transfert de proton) est la transformation chimique qui a lieu lorsque l’acide d’un couple échange un proton avec la base d’un autre couple pour former leurs base et acide conjugués. L’équation bilan de la réaction est la suivante :
A1H + A2– ==> A1– + A2H
Exemples :
- Réaction entre l’acide éthanoïque, acide du couple CH3COOH/CH3COO–, et l’ammoniac, base du couple NH4+/NH3 :
CH3COOH + NH3 ==> CH3COO– + NH4+
- Du fait de son caractère amphotère dans les couples H3O+/H2O et H2O/HO–, l’eau peut réagir avec elle-même. Cette réaction est appelée autoprotolyse de l’eau :
2 H2O ==> H3O+ + HO–
IV- PH d’une solution aqueuse
Les réactions acido-basiques font intervenir un transfert d’ions H+. Lorsqu’on est en solution aqueuse (donc où le solvant est l’eau), on va définir le caractère acide ou basique de la solution en fonction de la quantité d’ions H+ présents en solution. Or dans l’eau l’ion H+ n’existe pas en tant que tel, il est associé à une molécule d’eau pour former l’ion oxonium selon la demi-équation suivante : H2O + H+ = H3O+.
IV-1. Définition du pH
Le potentiel hydrogène, ou pH, d’une solution aqueuse, est lié à la concentration en ion oxonium H3O+ par la formule suivante :
Avec C0 = 1 mol.L−1 la concentration de référence.
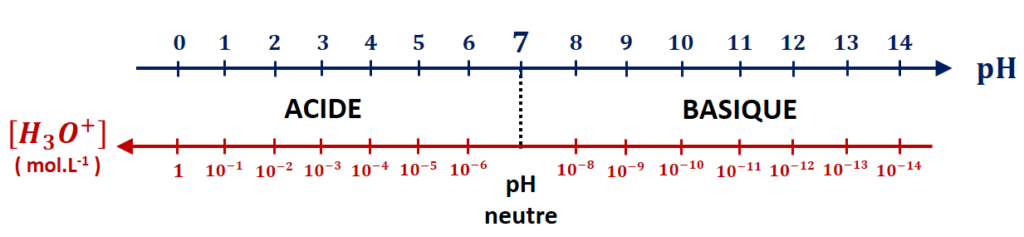
IV-2. Échelle de pH dans l’eau
Dans l’eau, la valeur du pH est comprise entre 0 et 14. Le pH central est donc 7, on l’appelle le pH neutre.
- Si 7 < pH < 14, on dit que la solution est basique (il y a davantage d’ions HO– que d’ions H3O+ en solution).
- Si 0 < pH < 7, on dit que la solution est acide (il y a davantage d’ions H3O+ que d’ions HO– en solution)
IV-3. Mesure du pH
Pour mesurer le pH d’une solution aqueuse, on peut utiliser deux méthodes:
- Du papier pH que l’on trempe dans la solution et qui indique de manière approximative son pH grâce à un code couleur.
- Un pH-mètre, appareil muni d’une sonde pH-métrique que l’on immerge dans la solution et qui indique une valeur plus précise du pH.
Pour plus de détails télécharger les documents ci-dessous:
Liens de téléchargement des cours sur la Réaction acido-basique
Cours sur la Réaction acido-basique N°1
Cours sur la Réaction acido-basique N°2
Cours sur la Réaction acido-basique N°3
Cours sur la Réaction acido-basique N°4
Cours sur la Réaction acido-basique N°5
Cours sur la Réaction_acido-basique N°6
Liens de téléchargement des résumés sur Réaction acido-basique
Résumé sur la Réaction acido-basique N°1
Résumé sur la Réaction acido-basique N°2
Résumé sur la Réaction acido-basique N°3
Résumé sur la Réaction acido-basique N°4
Liens de téléchargement des exercices corrigés sur Réaction acido-basique
Exercices corrigés sur la Réaction acido-basique N°1
Exercices corrigés sur la Réaction acido-basique N°2
Exercices corrigés sur la Réaction acido-basique N°3
Exercices corrigés sur la Réaction acido-basique N°4
Exercices corrigés sur la Réaction acido-basique N°5
Exercices corrigés sur la Réaction acido-basique N°6
